José Manuel Díaz Cao [1], Alberto Prieto [1], Pablo Díaz [1], Javier Moral [2], Antonio Iglesias [3], Luis Ángel Quintela [4], Patrocinio Morrondo [1] y Gonzalo Fernández [1].
1. Investigación en Sanidad Animal de Galicia (Invesaga). Departamento de Patología Animal. Facultad de Veterinaria de Lugo (USC).
2. Sociedad Veterinaria del Eo SLP, Vegadeo, Asturias.
3. Departamento de Anatomía y Producción Animal. Facultad de Veterinaria de Lugo (USC).
4. Departamento de Patología Animal. Unidad de Reproducción y Obstetricia. Facultad de Veterinaria de Lugo (USC).
Imagen cedida por los autores.
El herpesvirus bovino 4 (BoHV-4) ha adquirido una progresiva consideración en la patología reproductiva bovina en los últimos años y sin embargo es relativamente desconocido en la práctica clínica veterinaria. Su asociación con la enfermedad clínica ha sido siempre un tema controvertido, al aislarse tanto en animales sanos como en otros con diversidad de signos clínicos. El BoHV-4 comparte algunas características con otros herpesvirus bovinos (como el responsable de la IBR): es capaz de establecer infecciones latentes que pueden reactivarse ante un estímulo inmunosupresor (Dubuisson et al., 1989); pero en general, presenta importantes diferencias, sobre todo a nivel biológico, genético y antigénico. De forma general, se considera que la principal célula de latencia son los macrófagos (Donofrio y van Santen, 2001). Esto supone un arma de doble filo a la hora de entender la asociación del patógeno con la enfermedad. Por un lado, justifica su presentación en diferentes patologías: la llamada a las células inflamatorias tras una infección localizada puede llevar a que el virus sea transportado hasta la zona lesionada, dónde puede replicarse activamente y contribuir al agravamiento del proceso. Pero, por otra parte, no permite descartar fácilmente que la detección del virus sea debida a que sea transportado a una zona inflamada desempeñando un efecto testimonial. En este contexto, cuando han intentado reproducirse diferentes signos clínicos experimentalmente, la obtención de un cuadro clínico similar al detectado en los animales ha tenido un éxito variable e inconsistente. Por lo que en el pasado ha sido considerado un virus pasajero (Thiry et al., 2000). Sin embargo, una serie de artículos recientes han llamado la atención respecto a su potencial asociación con enfermedades reproductivas, principalmente metritis. Además, estudios in vitro han demostrado su tropismo por las células endometriales (Donofrio et al., 2007).
Como se trata de un virus con una alta variabilidad genómica y se ha hallado en diferentes patologías, se ha postulado la existencia de diferentes cepas que pudiesen verse o no involucradas en diferentes enfermedades. En la actualidad los aislamientos se clasifican en tres linajes (Bublot et al., 1990), pero no existen evidencias de asociaciones concretas. Más aún, se ha hipotetizado la posibilidad de que se produzcan mutaciones genéticas que provoquen patogenicidad en cepas apatogénicas (Frazier et al., 2002).
Metritis
Las metritis posparto bovinas son una de las principales manifestaciones clínicas en las que se ha sospechado de la implicación del BoHV-4. A nivel de campo se relaciona con el establecimiento de brotes de metritis graves que no responden bien a los tratamientos antibióticos. La primera vez que se aisló el BoHV-4 en casos de este tipo data de 1973 (Parks y Kendrick, 1973) y desde entonces han sido numerosas las ocasiones en las que el virus ha sido detectado en las descargas vaginales de animales con metritis. A pesar de ello, solo existe la reproducción experimental con signos clínicos similares y reaislamiento vírico, con la inoculación de la cepa LVR-140 en vacas gestantes (Wellemans et al., 1986). El resultado fue la aparición de metritis tras la gestación, pero sin demostrar una asociación primaria.
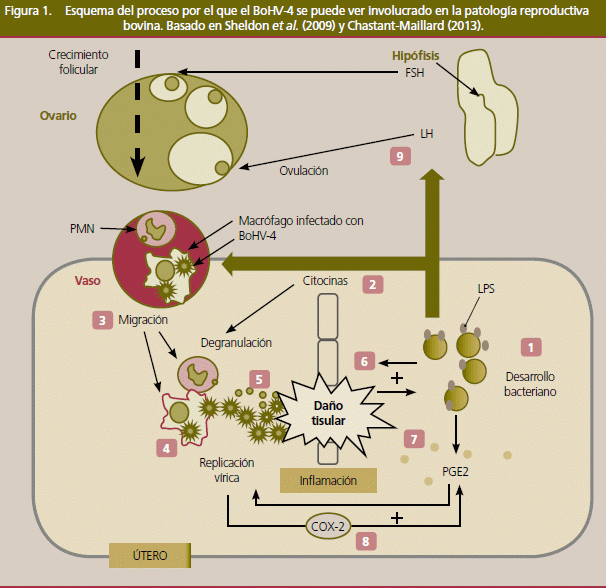
No obstante, en los últimos años, varios trabajos han comunicado la asociación entre la aparición de metritis y la presencia del patógeno (Frazier et al., 2002; Monge et al., 2006; Welchman et al., 2012). Graham et al. (2005) detectaron también la presencia del virus en animales con clínica, pero sin diferencias serológicas entre animales afectados y sanos, cuestionando la implicación del virus como agente patógeno primario. En este sentido, es un hecho frecuente el aislamiento de otros patógenos bacterianos, reconocidos responsables de enfermedad uterina (Trueperella pyogenes, Streptococcus spp., Escherichia coli), en concomitancia con la detección del virus en descargas vaginales (Banks et al., 2008; Graham et al., 2005; Monge et al., 2006; Welchman et al., 2012). Esto ha llevado a proponer un rol secundario del virus como agente favorecedor de la acción patógena de estas bacterias. Donofrio et al. (2005) mostraron que la replicación del BoHV-4 se ve estimulada por la prostaglandina E2. Esta sustancia puede producirse en el endometrio como consecuencia de una inflamación debida al desarrollo bacteriano, de forma que puede activar la replicación vírica provocando la lisis de las células endometriales y creando un ambiente favorable para el desarrollo bacteriano (figura 1). click para descargar.
En consecuencia, estos hallazgos sugieren que el virus actúa como un factor predisponente, a través de una cooperación bacteriana, para el desarrollo bacteriano (Sheldon et al., 2009). La colonización bacteriana es un hecho frecuente en el posparto. En la mayor parte de los casos, la presencia bacteriana se aclara conforme avanza el posparto sin establecerse una infección. De esta forma, la presencia de un agente favorecedor en este momento fisiológico de la vaca es un importante factor de riesgo, más aún cuando es capaz de producir infecciones latentes y factores como el parto se han mostrado sospechosos de revertir dicha latencia (Graham et al., 2005; Wellemans et al., 1986)
De esta forma, en la actualidad existen sospechas fundadas del rol del BoHV-4 como al menos un cofactor para las metritis posparto. En nuestra experiencia, se han detectado casos que concuerdan con la implicación del BoHV-4 en metritis agudas (Díaz-Cao et al., 2015).
La presencia del virus en la cabaña ganadera podría ser común, por lo que vale la pena considerarlo en casos de metritis graves. Aunque probablemente sea necesario una confluencia de varios elementos (exposición al virus, colonización bacteriana y, tal vez, algún desorden metabólico o nutricional) para establecer el proceso (Frazier et al., 2002).
Abortos
El papel del BoHV-4 como causa de abortos se ha sospechado básicamente a través de datos epidemiológicos. Czaplicki y Thiry (1998) mostraron que los animales seropositivos al virus presentaron un mayor riesgo a la aparición de abortos. Kendrick et al. (1976) consiguieron producir el aborto en algunos fetos inoculando un aislamiento procedente de metritis. Sin embargo, ningún mecanismo causal ha sido establecido hasta la fecha. En una encuesta de 10 años de abortos bovinos fue detectado en el 5 ‰ de los casos (Kirkbride, 1992). Egyed et al. (2011) mostraron que el virus puede transmitirse intrauterinamente, aunque no con gran eficacia y de forma aparentemente asintomática. Estos hechos indicarían un rol poco importante como patógeno primario fetal. No obstante, coinfecciones con otros patógenos han sido demostradas (Reed et al., 1979). Se ha sospechado siempre de una acción inmunosupresora del virus y podría actuar favoreciendo a otros patógenos abortivos.
El virus también puede estar involucrado en el aborto por otra vía: como resultado del establecimiento de una placentitis (Deim et al., 2006). Una replicación viral en la placenta puede ser suficiente para alterar la funcionalidad de este tejido y terminar la gestación, y puede tener un efecto facilitador de la acción patógena de otros agentes.
Por otra parte, en España, ha sido detectada la presencia del virus en casos de abortos asociados posteriormente con metritis (Díaz-Cao et al, 2014). El aumento de los títulos de anticuerpos durante el periparto es un hecho comúnmente observado (Wellemans et al, 1986; Graham et al, 2005), lo que plantea la cuestión de si un episodio abortivo puede suponer un desencadenante para la reactivación de la infección. De esta manera, animales infectados podrían tener un mayor riesgo de sufrir metritis tras el aborto, lo que empeoraría más aún las consecuencias económicas de un episodio abortivo. De esta forma, es interesante incluirlo en el diagnóstico diferencial de estas patologías (tablas 1 y 2).
 |
Endometritis e infertilidad
La seropositividad al BoHV-4 ha sido asociada con un mayor riesgo a la infertilidad (Gür y Doğan, 2010) y a un alargamiento del intervalo parto-concepción (Kale et al, 2011). El mecanismo por el que pueden aparecer estas manifestaciones es a través del establecimiento de una endometritis. De forma similar a la descrita en el apartado de metritis, la endometritis puede favorecerse por una colaboración entre el virus y bacterias colonizadoras del posparto (figura 1). Así, la proliferación del BoHV-4 en el endometrio puede provocar daños tisulares que favorezcan el crecimiento bacteriano. En esta situación la secreción de GnRH y LH se ve afectada reduciéndose la capacidad de ovular del folículo dominante. El mecanismo por el que se afecta la fertilidad es similar al descrito para otros casos de endometritis (para revisión: Sheldon et al., 2009) y el rol vírico es esencialmente cooperador. Debe tenerse en cuenta que en los casos de endometritis, si llega a producirse una ovulación el ciclo ovárico se reinicia, pero la concentración plasmática de progesterona es posiblemente más baja que en una vaca fértil, por lo que la probabilidad de mantenimiento de gestación también se ve afectada, pudiendo producirse casos de mortalidad embrionaria.
En Hungría el virus fue aislado en el 87,1 % de una muestra de vacas infértiles sacrificadas en el matadero (Fábián et al., 2008). Sin embargo, los autores no encontraron asociaciones primarias claras y la detección del virus se acompañó de aislamiento de diferentes tipos bacterianos con los que podría estar interrelacionado.
Bibliografía
Banks, M., Ibata, G., Murphy, A.M., Frossard, J.P., Crawshaw, T.R., Twomey, D.F., 2008. Bovine lymphotropic herpesvirus and non-responsive post-partum metritis in dairy herds in the UK. Vet. J. 176, 248–50.
Bublot, M., Vanbressem, M.F., Thiry, E., Dubuisson, J., Pastoret, P.P., 1990. Bovine Herpesvirus-4 Genome - Cloning, Mapping and Strain Variation Analysis. J. Gen. Virol. 71, 133–142.
Czaplicki, G., Thiry, E., 1998. An association exists between bovine herpesvirus-4 seropositivity and abortion in cows. Prev. Vet. Med. 33, 235–240.
Deim, Z., Szeredi, L., Tompó, V., Egyed, L., 2006. Detection of bovine herpesvirus 4 in aborted bovine placentas. Microb. Pathog. 41, 144–148.
Diaz-Cao, J.M., Prieto, A., Fernández, G., Moral, J., 2015. Diagnóstico por PCR y análisis serológico de Herpesvirus Bovino tipo 4 como posible causa de metritis agudas. Boletín de Anembe 107, 21–26.
Díaz-Cao, J.M., Prieto, A., Pérez, I., Díaz, P., Díez-Baños, P., Morrondo, P., Fernández, G., 2014. Presencia del Herpesvirus Bovino 4 en casos de aborto bovino, in: ANEMBE. p. 281.
Donofrio, G., Cavirani, S., van Santen, V., Flammini, C.F., 2005. Potential secondary pathogenic role for bovine herpesvirus 4. J. Clin. Microbiol. 43, 3421–3426.
Donofrio, G., Herath, S., Sartori, C., Cavirani, S., Flammini, C.F., Sheldon, I.M., 2007. Bovine herpesvirus 4 is tropic for bovine endometrial cells and modulates endocrine function. Reproduction 134, 183–197. Donofrio, G., van Santen, V.L., 2001. A bovine macrophage cell line supports bovine herpesvirus-4 persistent infection. J. Gen. Virol. 82, 1181–1185.
Dubuisson, J., Thiry, E., Bublot, M., Thomas, I., Van Bressem, M.F., Coignoul, F., Pastoret, P.-P., 1989. Experimental infection of bulls with a genital isolate of bovine herpesvirus-4 and reactivation of latent virus with dexamethasone. Vet. Microbiol. 21, 97–114.
Egyed, L., Sassi, G., Tibold, J., Mádl, I., Szenci, O., 2011. Symptomless intrauterine transmission of bovine herpesvirus 4 to bovine fetuses. Microb. Pathog. 50, 322–325.
Fábián, K., Makrai, L., Sachse, K., Szeredi, L., Egyed, L., 2008. An investigation of the aetiological role of bovine herpesvirus 4 in bovine endometritis. Vet. J. 177, 289–292.
Frazier, K.S., Baldwin, C. a., Pence, M., West, J., Bernard, J., Liggett, A., Miller, D., Hines II, M.E., 2002. Seroprevalence and Comparison of Isolates of Endometriotropic Bovine Herpesvirus-4. J. Vet. Diagnostic Investig. 14, 457–462.
Graham, D. A., McNeill, G.J., Calvert, V., Mawhinney, K., Curran, W., Ball, N.W., Todd, D., 2005. Virological and serological evidence of bovine herpesvirus type 4 in cattle in Northern Ireland. Vet. Rec. 157, 539–543.
Gür, S., Doğan, N., 2010. The possible role of bovine herpesvirus type-4 infection in cow infertility. Anim. Sci. J. 81, 304–308.
Kale, M., Ata, A., Kocamüftüoglu, M., Hasircioglu, S., 2011. Bovine herpesvirus type 4 (BHV-4) infection in relation to fertility in repeat breeder dairy cows. Acta Vet. 61, 13–19.
Kendrick, J.W., Osburn, B.I., Kronlund, N., 1976. Pathogenicity studies on a bovine herpesvirus. Theriogenology 6, 447–462.
Kirkbride, C. A., 1992. Viral Agents and Associated Lesions Detected in a 10-Year Study of Bovine Abortions and Stillbirths. J. Vet. Diagnostic Investig. 4, 374–379.
Monge, A., Elvira, L., Gonzalez, J. V, Astiz, S., Wellenberg, G.J., 2006. Bovine herpesvirus 4-associated postpartum metritis in a Spanish dairy herd. Res. Vet. Sci. 80, 120–125.
Parks, J.B., Kendrick, J.W., 1973. The isolation and partial characterization of a herpesvirus from a case of bovine metritis. Arch. Gesamte Virusforsch. 41, 211–215.
Reed, D., Langpap, T., Bergeland, M., 1979. Bovine abortion associated with mixed Movar 33/63 type herpesvirus and bovine viral diarrhea virus infection. Cornell Vet. 69, 54–66.
Sheldon, I.M., Cronin, J., Goetze, L., Donofrio, G., Schuberth, H.-J., 2009. Defining postpartum uterine disease and the mechanisms of infection and immunity in the female reproductive tract in cattle. Biol. Reprod. 81, 1025–1032.
Thiry, E., Markine-Goriaynoff, N., Minner, F., Pastoret, P.P., Vanderplasschen, A., 2000. L’Herpesvirus bovin de type 4: virus pathogéne ou passager? Le Point Vet. 31, 49–55.
Welchman, D.D.B., Verkuijl, A.M., Pepper, W.J., Ibata, G., King, SA, Davidson, H.M., Mawhinney, I.C., Banks, M., 2012. Association of gammaherpesviruses and bacteria with clinical metritis in a dairy herd. Vet. Rec. 170, 207.
Wellemans, G., van Opdenbosch, E., Mammerickx, M., 1986. Inoculation experimentale du virus LVR 140 (Herpês Bovin IV) à des vaches gestantes et non-gestantes. Ann. Rech. Vétérinaires 17, 89–94.